服務熱線
177-5061-9273

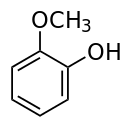
愈創木酚(guaiacol)(或作愈創木酚,得名于原產自拉丁美洲的愈創樹)是一種天然有機物,分子式為 C6H4(OH)(OCH3)。這種無色芳香油狀化合物是木餾油的主要成分,可從愈創木樹脂、松油等制取。常見的愈創木酚因暴露在空氣中或光照下而呈現深色。由于木質素的分解,木柴燃燒時產生的煙霧中含有愈創木酚。許多食物因含有愈創木酚而具有特殊氣味,例如烘焙咖啡豆。熏制食物的特殊風味主要屬愈創木酚與丁香酚的作用。愈創木酚遇三氯化鐵變為藍色。GB 2760—96規定為暫時允許使用的食用香料。主要用于配制咖啡、香草、熏煙和煙草等型香精。
愈創木酚
IUPAC名:2-甲氧基苯酚
別名:鄰甲氧基苯酚;鄰苯二酚甲醚
化學性質:白色或微黃色結晶或無色至淡黃色透明油狀液體。有特殊芳香氣味。略溶于水和苯。易溶于甘油。與乙醇、乙醚、氯仿、油類、冰醋酸混溶。嗅覺閾值(Odor Threshold): 0.0074ppm。
| 識別 | |
| CAS號 | 90-05-1 |
| FEMA | 2532 |
| PubChem | 460 |
| ChemSpider | 447 |
| 性質 | |
| 化學式 | C7H8O2 |
| 摩爾質量 | 124.14克/摩爾 g·mol?1 |
| 密度 | 液態1.112 g/cm3 固態1.129 g/cm3 |
| 熔點 | 28 °C(301 K) |
| 沸點 | 204-206 °C |
| 若非注明,所有數據均出自一般條件(25 ℃,100 kPa)下。 | |
制備
在自然界中愈創木酚存在于愈創樹脂或松油中,在木材干餾所得的雜酚油中,愈創木酚是主要的成分,將雜酚油分餾可得該品。日本大阪精化公司以鄰硝基氯苯為原料,制成鄰硝基苯甲醚,進而還原為鄰氨基苯甲醚,最后制得該品。我國生產方法與此大致相同。原料消耗定額:含氨基苯甲醚1250kg/t、硫酸(93%)1500kg/t、亞硝酸鈉700kg/t、硫酸銅400kg/t。工業上常通過對鄰苯二酚甲基化生產愈創木酚。例如用碳酸鉀與硫酸二甲酯和鄰苯二酚反應:
C6H4(OH)2+ (CH3O)2SO2 → C6H4(OH)(OCH3) + HO(CH3O)SO2
愈創木酚也可以通過干餾木材制得的木餾油得到其混合物。
實驗室制備
愈創木酚有多種實驗室制法。例如可以以鄰硝基氯苯為原料,通過威廉姆遜合成法合成鄰硝基苯甲醚,再還原硝基為氨基,最后通過重氮化水解反應合成最終目標產物。中國與日本企業也常用此途徑工業生產愈創木酚。另一種合成愈創木酚的方法是鄰苯二酚甲基化后再選擇性部分水解:
C6H4(OCH3)2+ C2H5SNa → C6H4(OCH3)(ONa) + C2H5SCH3
毒性
LD50 900 mg/kg(大鼠,皮下)。LD50 3.7mg/kg(家兔,靜注)。大量口服可刺激食道和胃部,以致心肌衰竭、虛脫而致死。
使用限量
FEMA(mg/kg):軟飲料0.95;冷飲0.52;糖果0.96;焙烤食品0.75。適度為限(FDA§172.515,2000)。
用途
愈創木酚在工業上用途廣泛。常用愈創木酚來生產各種香料,如丁香油酚、香蘭素和人造麝香。愈創木酚在醫藥上也有大量應用,它可被用于合成苯磺酸愈創木酚(愈創木酚磺酸鉀)、用作局部麻醉劑或防腐劑,還可以祛痰和治療消化不良。因為具有還原性,常在化妝品中少量添加作為抗氧化劑并常與增效劑、金屬離子螯合劑等一同使用。因為與氧反應會顯深色,愈創木酚還被用作染料。愈創木酚也用作有機合成原料及分析測定的標準物質。
相關化合物
愈創木酚與甘油形成的醚(愈創甘油醚)是常用祛痰藥,又稱格力特或去咳露。愈創木酚的另一種衍生物鄰苯二甲醚(又稱白藜蘆素或藜蘆醚)也是常用化工產品。
安全性
愈創木酚可被用作吸入煙霧的指示物,因為從食物中攝取的愈創木酚量遠多于通過呼吸吸入的煙氣中的愈創木酚含量。
愈創木酚的生物合成
1、 結合轉錄組和蛋白質組分析探討酸地脂環芽孢桿菌產愈創木酚的機制
脂環芽孢桿菌(Alicyclobacillus spp.)可導致商業巴氏滅菌的果汁/飲料變質,變質的特征是形成一種獨特的藥用或防腐劑的異味,歸因于愈創木酚。本研究旨在結合轉錄組學和蛋白質組學方法,揭示酸土脂環酸芽孢桿菌(Alicyclobacillus acidoterrestris)產生愈創木酚的機制。通過RNA測序和iTRAQ分析,研究了產(含500 μM香草酸)和不產(不含香草酸)愈創木酚時,酸土脂環酸芽孢桿菌基因和蛋白表達水平的差異。共鑒定出225個差異表達基因和77個差異表達蛋白。編碼香草酸脫羧酶亞基的基因vdcBCD的轉錄分別上調了626.47、185.01和52.81倍;它們是愈創木酚生產中上調最多的基因。苯甲酸膜轉運蛋白、鐮刀酸抗性蛋白、抗性-結節-分裂轉運蛋白、一些ATP結合盒轉運蛋白和主要促進因子超家族轉運蛋白在mRNA、蛋白或兩個水平上的表達均增加。說明它們參與了香草酸的吸收和愈創木酚的合成。在酸土脂環酸芽孢桿菌利用香草酸合成愈創木酚的代謝過程中,三羧酸循環途徑和核糖體相關基因表達上調,而纈氨酸、亮氨酸和異亮氨酸生物合成相關基因表達降低。這些發現為了解愈創木酚的產生機制提供了新的思路,為果汁工業中愈創木酚的防治提供了重要的指導。
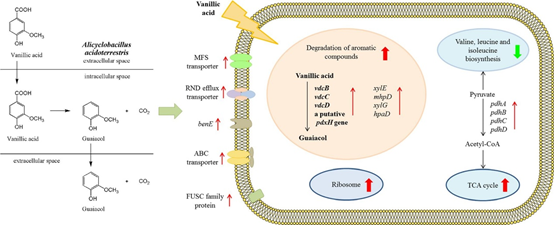
圖1 愈創木酚的生物合成示意圖 [1]
愈創木酚在香精行業中的應用
天然香草香精的鑒定:將香草醛降解成愈創木酚的同位素表征 [2]
本文將香蘭素的同位素研究擴展到近年來發現的香蘭素天然前體的新來源,以期通過生物技術方法獲得天然香蘭素。為了檢驗香草醛的同位素組成與相應芳香族片段的一致性,進行了愈創木酚選擇性降解反應。實驗表明,該反應可以在沒有顯著的同位素分餾的情況下進行,并從實驗設計的結果中確定了一個優化的過程,該實驗設計包括了試劑的數量、溫度和實驗時間。愈創木酚是碳氧同位素比值質譜(IRMS)測定的一種有趣的同位素探針。它提供了芳香片段特定的(13)C信息,并結合香蘭素本身測量的(13)C值,提高了碳- IRMS的鑒定潛力。因此,阿魏酸的自然狀態可以通過在甲酰位點大量消耗C來表征。同樣,愈創木酚的氧-18含量是比香蘭素的δ (18)O更好的鑒定工具,因為在工業或實驗室程序中,它不受sp(2)氧原子與水的化學交換所改變的缺點。盡管協作研究仍是必要的,以提高delta(18)O參數的實驗室間重現性,但在實驗室內部可以獲得一致的結果。特別表明,阿魏酸的化學氧化特征是香蘭素的芳香部分的相對富集。
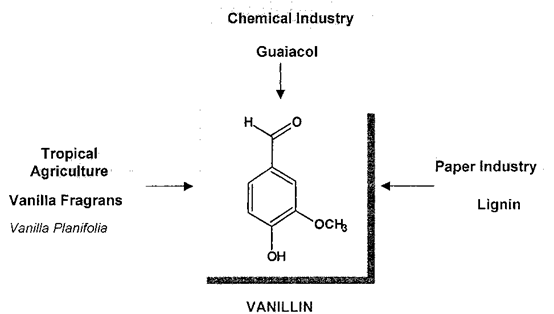
圖2 香蘭素的三大來源
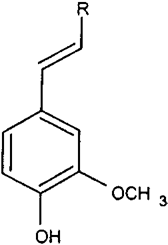
圖3 香蘭素前體分子結構:1a, R) CH3(異丁香酚);1b, R) COOH(阿魏酸);1c, R) COCH2R '(姜黃素)。1a?c如圖4所示。
人們對香草的鑒定進行了大量研究,認為從香草豆中提取的天然產品比其合成或半合成的同類產品價值高得多。穩定同位素分析,通過同位素比質譜(IRMS)和核磁共振(SNF- NMR)進行,為區分香莢蘭豆和其他兩個重要來源愈愈木酚和木質素提供了非常強大的工具(圖2)。對香草口味的需求增加,香莢蘭豆天然提取物的供應相對短缺,這催生了市場上主要調味成分香草醛的新來源的開發。這些來源主要是依然來自于天然產物的前體,其分子結構如圖3中所述,R) - CH3(異丁子香酚,1a,從丁香酚的丁香油),R)羧基(阿魏酸,1 b,從米糠或甜菜漿),或R) CO-CH2-R”(姜黃素,1 c,從姜科的根)。從這些分子中得到的香蘭素涉及到側雙鍵的氧化裂解(圖4)。
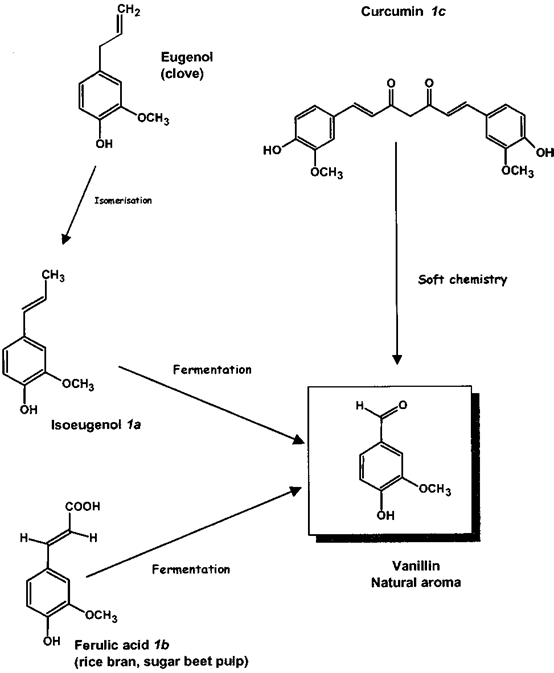
圖4 從阿魏酸、姜黃素或異丁香酚中提取的香草醛的新來源。
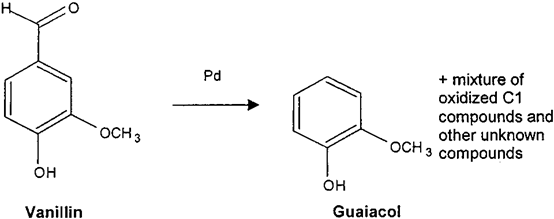
圖5 香草醛降解為愈創木酚的反應式
因此,身份驗證問題是雙重的。首先,前體的天然狀態需要驗證,其次,將前體轉化為香草醛的過程必須保證不經過任何化學步驟。之前的研究已經確定了甲酰基或甲氧基是否因非法操作香草醛分子而發生了任何不尋常的13C或2H富集。最近,香蘭素的氧同位素比值δ18O也被提出作為區分天然樣品與愈創木酚和木質素來源的有效附加參數。然而,在任何制備和純化步驟中,香蘭素甲酰基的氧原子很容易與水發生化學交換。因此,有必要開發一種新的工具來克服18O程序的這一缺點,并將香草醛降解成愈創木酚被認為是擺脫了這一缺點。考慮到鑒定標準的需要,包括香草醛的新生物技術來源,這項工作的目的還在于根據碳和氧同位素數據確定不同前體香草醛樣品的置信域,并研究氧化裂解對所得分子的同位素參數的影響。(香草醛轉化成愈創木酚的研究。該反應涉及到苯-甲酰鍵與鈀的催化裂解(圖4)。在一個裝有冷凝器的250ml圓底燒瓶中,注入等量的香草醛(至少200mg)和1% w/w的沉積在活性炭上的鈀。手動攪拌混合物,在210℃的油浴中回流2小時。然后將混合物冷卻到室溫30分鐘,所得愈創木酚溶解在30-40毫升二氯甲烷中。然后在真空條件下,通過熔塊玻璃漏斗(No. 4.))
碳同位素比值。對于來自天然前體(豆類、阿魏酸、木質素和異丁香酚)的香草醛,愈創木酚分子在13C中略有富集(樣本1b除外)。計算的平均值為1.3‰。相比之下,化石前體則略有減少(≈-1‰)。這種行為表明,在合成產物中,相對于來自天然來源的相同片段,香草醛的甲酰基在13C中富集。這一觀察結果與氫同位素參數的典型行為相一致,與用于合成香草醛的乙醛酸的高13C含量(~ -20‰)相一致。與Krueger和Nicol的結果一致。盡管公式1計算的δ13C(CHO)值精度有限,但可以得出結論,香草醛從非天然阿魏酸中損失的甲酰基特別高(樣品4和6a-c的δ13C值在-38‰和-67‰之間)。這些結果有力地支持了從天然阿魏酸中提取香草醛的δ13C值(平均δ13C值為-36.9‰,樣品4和樣品6a-c)來確定其天然狀態。此外,香蘭素前體天然阿魏酸(δ13C) -34.4‰樣品4和6a-c)與米糠阿魏酸(δ13C) -35.5‰樣品的平均13C含量相似。
氧同位素比率。在實踐中,氧同位素比率在認證程序中并不起重要作用。如前一節所討論的,實驗室間重復性的低水平使絕對值的比較變得復雜,結果通常必須在相對的基礎上解釋。此外,必須考慮到由于氧交換而喪失選擇性的風險。因此,在香草醛的情況下,sp2氧原子很可能在樣品的提取和制備過程中與水發生交換,香草醛本身并不是一種方便的18O-IRMS通用探針。原則上,從香草醛中提取的愈創木酚較好地避免了交換的風險。此外,其δ18O值僅為兩個位置以上的平均值,表現出較高的選擇性。還可以確定更多的選擇性參數,但代價是要進一步降解香草醛反應。Fronza等人最近發表了三種前體的選擇性δ18O值:香莢蘭豆、木質素和愈創木酚。結果表明,氧同位素分析提供了有關這三個氧原子起源的有趣的機制信息。從表3的結果可以評估愈創木酚作為18O-IRMS探針在合理時間內表征整個天然、化學和生物技術來源的鑒定潛力。結果表明,直接測定的合成和半合成香草醛的18O含量(δ18O)為8.9‰,樣品2a、b和3a-c),而從大豆中提取或從天然前體中提取的香草醛(δ18O)為14.1‰,樣品1a、b、4、6a c和7a、b)。這種差異可能與前體的特定性質無關,而是與提取過程的工業或實驗室性質有關,因為樣品2和3是商業工業產品,而其他樣品是在實驗室規模上制備和提取的。在嚴格標準化條件下獲得的愈創木酚有望提供一個氧同位素探針,代表唯一的非交換性原子,因此,較少依賴于樣品處理。雖然δ18O的變化范圍相當有限,但可以得出結論,阿魏酸雙鍵的化學氧化使香草醛的δ18O值比水溶液中酶的反應略有增加。
考慮到香草醛的經濟重要性和引進新的生物技術來源,人們對發展鑒定標準繼續有興趣。當提取的樣品數量足夠多時,SNIF-NMR方法對于區分香草醛的主要來源特別有效。然而,面對日益復雜的欺詐行為和對稀釋介質進行調查的需要,也可以利用內部質譜儀測定碳和氧同位素比率。本研究結果擴展了之前的研究,表明以香草醛為原料制備愈創木酚,在可重復同位素條件下,為測定碳氧同位素比值提供了一種新的探針,不受甲酰氧交換的干擾。當愈創木酚的結果與測定香草醛的同位素比率相結合時,也可以獲得甲酰基的同位素含量信息。結果表明,所建立的將香蘭素降解成愈創木酚的實驗方法是可靠、準確的。結果表明,愈創木酚的δ13C值與香草醛的δ13C值的均方差(MSD)為1.77,說明愈創木酚是鑒定香草醛前體的一個很好的補充指標。
愈創木酚的藥理活性
1、 抗氧化劑愈創木酚對禾谷鐮刀菌(Fusarium graminearum)生長及脫氧雪腐鐮刀菌烯醇的產生具有殺菌和抑制作用
從干木材蒸餾得到的雜酚油的主要成分愈創木酚是一種天然抗氧化劑,廣泛應用于醫藥和食品保鮮。然而愈創木酚的抗真菌機制尚不清楚。本研究發現愈創木酚對禾谷鐮刀菌的菌絲生長、分生孢子的形成和萌發以及脫氧雪腐鐮刀菌烯醇(DON)的生物合成具有一定的抑制作用,且呈劑量依賴關系。愈創木酚對標準菌株PH-1的中位有效濃度(EC50)值為1.838 mM。愈創木酚對孢子的產生和萌發有較強的抑制作用。愈創木酚的抗真菌作用可能與其破壞Ca2+轉運通道的能力有關。此外,愈創木酚處理降低了丙二醛(MDA)水平,降低了過氧化氫酶(CAT)、過氧化物酶(POD)和超氧化物歧化酶(SOD)活性,表明愈創木酚通過調節氧化反應來抑制真菌毒素脫氧雪腐鐮刀菌烯醇(Deoxynivalenol, DON)的產生。綜上所述,本研究揭示了抗氧化劑在抑制禾谷鐮刀菌中真菌毒素的潛力。
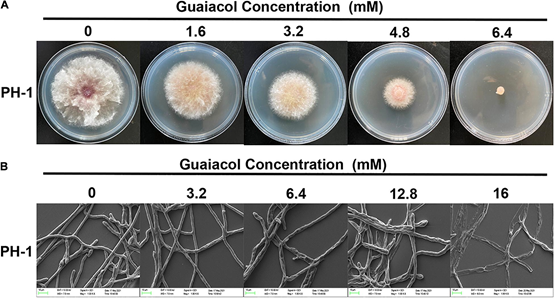
圖6 愈創木酚抑制禾谷鐮刀菌菌絲生長。(A)菌株PH-1在含愈創木酚(0-6.4 mM)的PDA平板上培養3 d,拍照并測量菌落直徑;(B)愈創木酚(0-16 mM)處理下禾谷鐮刀菌(禾谷鐮刀菌, PH-1)菌絲形態的SEM觀察[3]
不同濃度愈創木酚處理禾谷鐮刀菌PH-1,愈創木酚對菌絲生長的抑制呈劑量依賴性,6.4 mM愈創木酚完全抑制菌絲生長(圖6A)。愈創木酚對PH-1的EC50值為1.838 mM。此外,掃描電鏡(SEM)檢測了愈創木酚對禾谷鐮刀菌菌絲生長的影響,可以清楚地看出愈創木酚處理后菌絲形態發生了變化。與常規光滑的對照組菌絲不同,用16mM愈創木酚處理后菌絲明顯崩壞(圖6B)。
2、 漆酶催化合成愈創木酚寡聚物抗菌粉的研究
以漆酶為催化劑,采用酶催化聚合法制備愈創木酚低聚物。在水溶液中進行了紫外-可見光譜反應。用核磁共振和MALDI-TOF譜對其進行了表征。紫外-可見光譜觀察顯示,在380 ~ 530 nm范圍內形成了一個新的峰,表明新物質的形成。核磁共振結果表明,酚羥基參與了聚合反應。MALDI-TOF譜顯示愈創木酚寡聚物的質量平均聚合度為10,重復單元的質量為122。采用熱重分析(TGA/DSC)對其熱穩定性進行了研究。愈創木酚低聚物的熱穩定性優于愈創木酚,這可能與愈創木酚具有較長的共軛π鏈有關。ABTS自由基 dot+自由基的抗氧化活性呈濃度依賴性,在800 μg/mL時達到平臺。所得愈創木酚寡聚物對金黃色葡萄球菌和大腸桿菌均有一定的抑菌活性,抑菌率達99%。
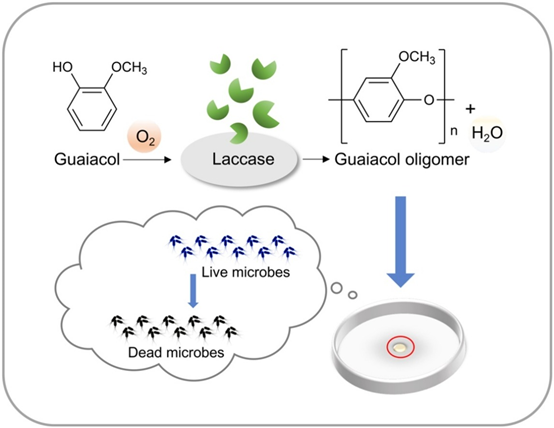
圖7 愈創木酚寡聚物合成的示意圖 [4]
3、 愈創木酚通過阻斷RANK與TRAF6和C-Src的相互作用以及抑制NF-κB、MAPK和AKT信號通路來抑制破骨細胞的形成
當歸(Angelica sinensis)是一種傳統的中藥,幾百年來一直被用于治療骨質疏松和骨壞死等骨病。但其有效成分和作用機制尚不清楚。通過二維細胞膜色譜/C18柱/飛行時間質譜(2D CMC/C18柱/TOFMS)鑒定愈創木酚為當歸的有效成分。愈創木酚在體外抑制骨髓單核細胞(BMMCs)和RAW264.7細胞的破骨細胞生成和破骨細胞功能,且呈劑量依賴性。免疫共沉淀提示愈創木酚阻斷了RANK-TRAF6和RANK-C-Src的關聯。愈創木酚可抑制p65、p50、IκB (NF-κB通路)、ERK、JNK、c-fos、p38 (MAPK通路)和Akt (Akt通路)的磷酸化,降低Cathepsin K、CTR、MMP-9和TRAP的表達水平。愈創木酚還抑制活化t細胞胞漿核因子1(NFATc1)的表達和rankl誘導的Ca2+變化。在體內,它通過抑制過度的破骨細胞生成來改善卵巢切除引起的骨丟失。綜上所示,愈創木酚通過阻斷RANK與TRAF6和C-Src的相互作用,以及抑制NF-κB、MAPK和AKT信號通路,從而抑制rankl誘導的破骨細胞形成。因此,該化合物顯示出治療破骨細胞發生相關骨疾病的潛力,包括絕經后骨質疏松癥。
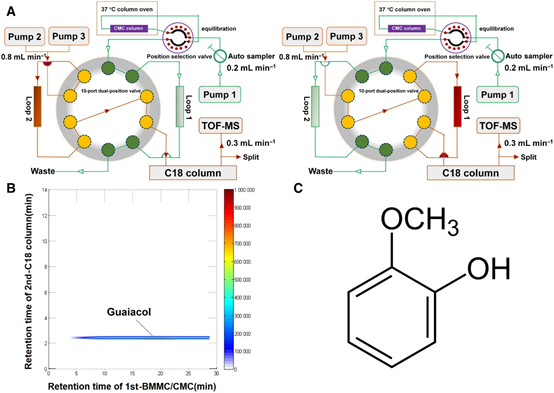
圖8 愈創木酚提取自AS。A、2D CMC/C18色譜柱/TOFMS系統。B,愈創木酚典型2D色譜儀。C、愈創木酚分子式 [5]
通過2D BMMC/CMC/C18柱/TOFMS分析,鑒定愈創木酚為as的活性成分,發現愈創木酚具有明顯的體外破骨細胞功能和破骨細胞生成抑制作用。通過阻斷RANKL/ m - csf和C-Src之間的相互作用,在早期降低RANKL/ m - csf誘導的NF-κB、MAPK和AKT信號通路的激活。在體內,它顯著減弱了ovx誘導的骨丟失(圖9)。
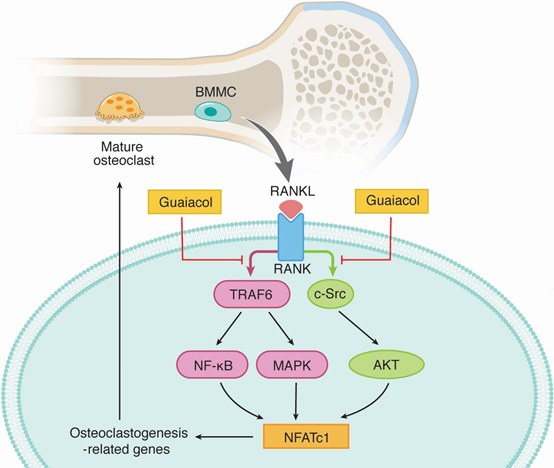
圖9 愈創木酚通過多種信號通路抑制破骨細胞分化和功能的機制 [5]
4、 酮洛芬與天然抗氧化劑(百里酚、薄荷醇和愈創木酚)可能互為前藥的新衍生物的設計與合成
非甾體抗炎藥(NSAIDs)是使用最廣泛的一類藥物。它們主要用于治療骨關節炎、類風濕關節炎和其他炎性疾病。然而,非甾體抗炎藥的使用是有限的,因為可能誘發胃腸道糜爛和潰瘍。近年來,在非甾體抗炎藥治療相關的胃潰瘍形成過程中,局部活性氧(ROS)的產生起著重要作用。因此,在本研究中,非甾體抗炎藥(酮洛芬)已與具有抗潰瘍活性的不同抗氧化劑(百里酚、薄荷醇和愈創木酚)結合。目的是獲得Ketoprfen -抗氧化衍生物的相互前藥,包括:酮洛芬-百里酚(化合物I)、酮洛芬-薄荷醇(化合物II)和酮洛芬愈創木酚(化合物III)。非甾體抗炎藥與抗氧化劑的相互前藥被指定為作為單一化學實體產生互補藥理作用,改善抗炎作用,減少潰瘍的不良反應。通過FT-IR、CHNS和理化性質確定了合成方法。[6]
參考文獻
[1] ZhouliWang, Yunhao Liang, Qi Wang, Hang Jia, Tianli Yue, Yahong Yuan, Zhenpeng Gao,Rui Cai,Integrated analysis of transcriptome and proteome for exploring themechanism of guaiacol production by Alicyclobacillus acidoterrestris, FoodResearch International, 2021,148,110621,doi.10.1016/j.foodres.2021.110621.
[2] Bensaid,Fatiha & Wietzerbin, Karine & Martin, Gérard. (2002). Authentication ofNatural Vanilla Flavorings: Isotopic Characterization Using Degradation ofVanillin into Guaiacol. Journal of agricultural and food chemistry. 50. 6271-5.10.1021/jf020316l.
[3] GaoTao, Zhang Yao, Shi Jianrong, Mohamed Sherif Ramzy, Xu Jianhong, Liu Xin. The Antioxidant Guaiacol Exerts FungicidalActivity Against Fungal Growth and Deoxynivalenol Production in Fusariumgraminearum. Frontiers in Microbiology,2021, 12, DOI.10.3389/fmicb.2021.762844
[4] NannanLi, Jing Su, Hongbo Wang, Artur Cavaco-Paulo, Production of antimicrobialpowders of guaiacol oligomers by a laccase-catalyzed synthesis reaction,Process Biochemistry,2021,111, Part 1, 213-220,doi.10.1016/j.procbio.2021.07.018.
[5] XinZhi,Chao Fang,Yanqiu Gu,Huiwen Chen,Xiaofei Chen,Jin Cui,Yan Hu,WeizongWeng,Qirong Zhou,Yajun Wang,Yao Wang,Hao Jiang,Xiaoqun Li,Liehu Cao,XiaoChen,Jiacan Su. Guaiacol suppresses osteoclastogenesis by blocking interactionsof RANK with TRAF6 and C-Src and inhibiting NF-κB, MAPK and AKT pathways.Journal of Cellular and Molecular Medicine, 2020, 24(9): 5122-5134.
[6]Shaheed, D.Q., Kareem, A., Mubarak,H., Abdul, A., Abbas, H.K., & Dakhil, M.A. (2015). DESIGN AND SYNTHESIS OFNEW DERIVATIVES OF KETOPROFEN LINKED TO NATURAL ANTIOXIDANTS (THYMOL, MENTHOL& GUAIACOL) AS POSSIBLE MUTUAL PRODRUGS.