服務熱線
177-5061-9273

中文名稱:紫蘇醇
中文同義詞:紫蘇醇;芥子醇;L-紫蘇醇;紫蘇醇標準品;紫蘇醇對照品;紫蘇醇25G;紫蘇醇、L-紫蘇醇、芥子醇、1-羥甲基-4-異丙烯基-1-環己烯
CAS號: 536-59-4
英文名稱: Perilla alcohol
英文同義詞:perilla; Perillol;(S)-(-)-PeriL;perillalcohol;1-perillalcohol; Perilla alcohol;; Perillic alcohol; 1,8-p-Menthadien-7-ol; L-(-)-Perilly Alcohol
CBNumber: CB0695703
分子式: C10H16O
分子量: 152.23
紫蘇醇的分子結構式
紫蘇醇化學性質
熔點: 271-272°C
沸點: 119-121°C 11mmHg(lit.)
密度: 0.96g/mL at 25°C(lit.)
FEMA: 2664 (p-Mentha-1,8-dien-7-ol)
折射率: n20/D1.501(lit.)
閃點: >230°F
儲存條件: Inertatmosphere,2-8°C
酸度系數(pKa):14.85±0.10(Predicted)
JECFA Number: 974
紫蘇醇性質、用途與生產工藝
概述
紫蘇醇學名4-異丙烯基-1-環己烯甲醇,有似芳樟醇和松油醇味的稠粘油液,存在于姜草油、青檸檬油、雜薰衣草油和留蘭香等油中。因具有芳香味道,常被用作食用香精和添加劑的調配劑。紫蘇醇作為一種治療及預防癌癥的單萜類藥物,在腫瘤如卵巢腫瘤、食道癌、乳腺癌等的治療方面有獨到的治療效果。
理化性質
粘稠油狀液體。有似芳樟醇和松油醇氣味。沸點118-121℃ (11×133.322Pa)。相對密度 0.9690。折光率1.4996 ,[α]D-7°。性質穩定, 耐熱耐酸, 不易揮發。
合成方法
紫蘇醇以游離態或酯的形式天然存在于柑桔、櫻桃、薄荷、香檸檬、姜草、雜薰衣草等多種植物中,是植物甲醛、戊酸代謝途徑產生的單萜化合物。原則上,紫蘇醇可從天然植物精油中單離獲得,如Row等采用有機溶劑或超臨界CO2萃取提取紫蘇醇。雖然紫蘇醇存在于多種天然植物精油中,但因含量太低、分離不易而成本過高,因此化學合成紫蘇醇就顯得尤為重要。有關紫蘇醇的合成,大多采用天然存在的單萜化合物為起始原料,經合適的化學轉化來進行的。
1、 苧烯氧化法
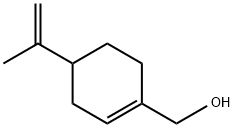
苧烯是檸檬油、甜橙油、香檸檬油、蒔蘿油等天然精油的主要成分, 因而其來源是相當豐富的 。從分子結構看, 苧烯與紫蘇醇具完全相同的分子骨架結構( 圖1) , 在適當的反應條件下, 苧烯可經氧化轉化生成紫蘇醇。
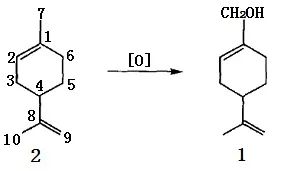
圖1 苧烯的分子結構
空氣或氧氣對苧烯的氧化作用或催化氧化曾有廣泛的研究,二氧化硒也可對其進行選擇性氧化。但由于苧烯氧化合成紫蘇醇是對烯丙位的甲基氫進行氧化,而苧烯分子中有5種不同的烯丙位的氫(如圖1所示的3、4、6、7和10位上的氫),因而通常氧化反應的產物十分復雜,紫蘇醇的選擇率很低。
2、β-蒎烯直接氧化法
Willing等在含有氯化亞銅、苯甲酸銅的乙腈中用過氧化二苯甲酰氧化β-蒎烯,獲得主要產物反式香芹醇(產率29.4%)和少量的紫蘇醇。夏克堅等采用同樣的方法進行β-蒎烯的氧化反應,紫蘇醇產率為73%。南京林業大學程芝等用四乙酸鉛作氧化劑,β-蒎烯經氧化或氧化酯化、皂化制得紫蘇醇,優化條件下紫蘇醇收率可達45%。直接氧化法所得紫蘇醇產率太低,且產物十分復雜,難以分離提純,因此應用價值不大。
3、以α-蒎烯為原料合成
以α-蒎烯為原料(4)合成紫蘇醇有2種方法,其一是以二氧化硒SeO2為氧化劑在醋酸-醋酐混合溶劑中發生烯丙位選擇氧化或氧化-酯化反應,生成桃金娘烯醇(5a)及其乙酸酯(5b),再經異構化、皂化即得1。
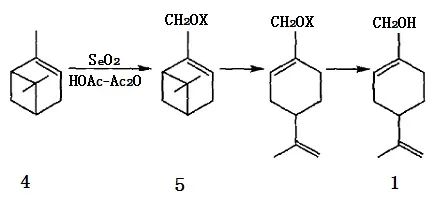
圖2 α-蒎烯用SeO2 氧化合成紫蘇醇
4、β-蒎烯環氧化物重排法
Bluthe等利用β-蒎烯環氧化物(6)在汞離子存在下與水作用,首先生成二醇,再在稀硫酸催化下脫水后可定量地轉化成紫蘇醇;這一方法在Sy-narome等的一份專利中也有報導,據稱紫蘇醇的得率可達98%,但反應中硫酸汞的用量幾乎是環氧蒎烷的一倍,實為不足之處。β-蒎烯環氧化物在酯酸鈉存在下與羧酸RCOOH(R=H、Me、Et、tPr)反應可轉化成醇和相應酯的混合物,經水解可制得紫蘇醇。2,10-環氧蒎烷的酸催化異構化是綜合利用我國資源豐富的松節油中的β-蒎烯來合成紫蘇醇的最有效的途徑,由于2,10-環氧蒎烷可以很方便地由β-蒎烯經環氧化反應制備,這也為β-蒎烯資源的綜合利用提供了一條新途徑(圖3)。
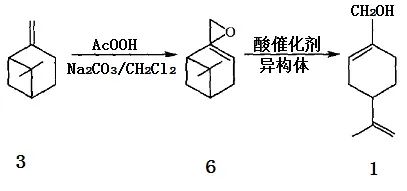
圖3 2, 10-環氧蒎烷在酸催化下的異構化反應
5、紫蘇醇的生物轉化
(1)、含CYP153A6的重組微生物細胞區域選擇性羥基化(S)-檸檬烯為(S)-紫蘇醇[1]
細胞生理是決定微生物生物催化劑反應效率的關鍵因素。為探索細胞色素P450單加氧酶CYP153A6重組惡臭假單胞菌細胞將(S)-檸檬烯羥基化轉化為(S)-紫蘇醇的有效工藝條件,對其生理參數進行了優化。之前報道的putida GPo12合成(S)-紫蘇醇的方法是基于復雜而敏感的辛烷攝食策略,表明了細胞生理學的關鍵作用。與之前的研究結果相比,對不同碳源的篩選表明,甘油和檸檬酸是辛烷的合適替代品,具有較高的檸檬烯羥基化活性。putida KT2440作為替代宿主菌株和檸檬酸鹽作為碳源改善了實際處理,并允許比活性增加7.5倍(22.6 U gCDW -1)。在兩液相生物轉化中,在24小時內生產了4.3 g (S)-紫蘇醇Ltot (-1),與以前報道的結果相比,生產率提高了6倍。因此,在活微生物細胞中選擇性細胞色素p450烴類氧化功能化過程中,細胞生理與目標生物轉化之間的關系至關重要,了解這一關系可以指導生物催化劑和生物過程的設計。
在本研究中,Cornelissen等詳細研究了是哪些生理參數限制了含CYP153A6的整個假單胞菌細胞催化(S)-檸檬烯羥基化為(S)-紫蘇醇(圖4),目的是開發一種高效的生物轉化過程。
雖然基于細胞色素細胞的生物氧化具有很高的工業應用潛力,但所取得的生產力往往太低,不具有經濟意義。在兩液相生物轉化中,(S)-檸檬烯轉化為(S)-紫蘇醇受細胞生理限制,而不受CYP153A6固有特性的限制。謹慎的宿主和碳源選擇允許休眠細胞的比活性增加7.5倍。在雙液相生物轉化中,優化的生理條件和過程控制轉化為6倍的生產率比以前報道的結果。確定的進一步限制包括底物可用性和過度氧化。可以預見,類似的參數限制了許多其他基于CYP2的生物轉化的反應效率。因此,強烈建議在設計全細胞催化劑時考慮生理效應。
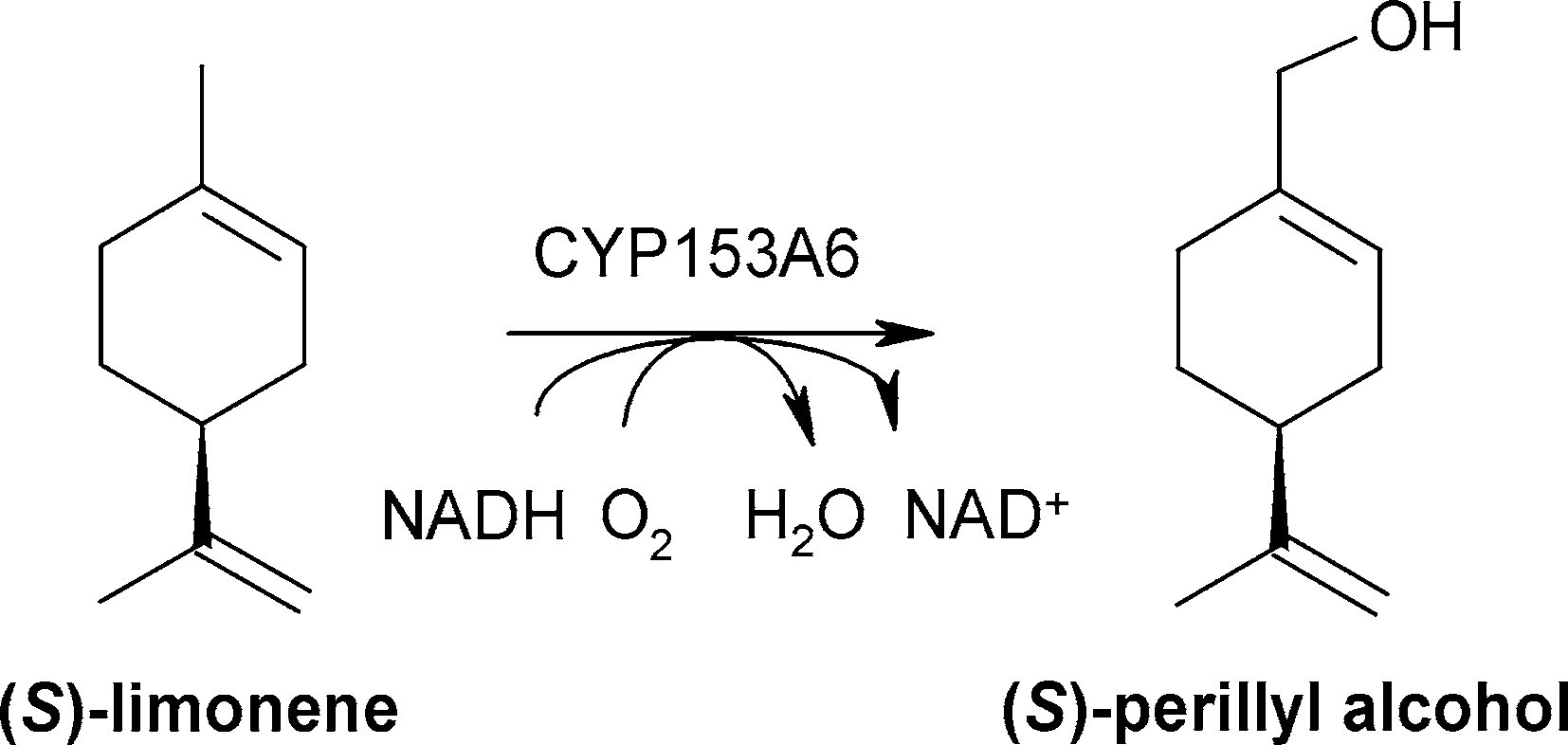
圖4 紫蘇醇的生物轉化 [1]
(2)、重組大腸桿菌對紫蘇醇生產的影響[2]
(R)-(+)-紫蘇醇是一種天然含氧單萜,廣泛用于天然香料添加劑、殺蟲劑、噴氣燃料和抗癌療法。它也是容易獲得的單萜前體。然而,這種天然產物存在于低濃度的植物來源,這在經濟上是不可行的。因此,微生物生產方法正迅速成為一種有吸引力的替代方法,使(R)-(+)-紫蘇醇生產更加可持續和環境友好。[2]
Sun等設計了一種外源的甲羥戊酸(MVA)途徑,包括檸檬烯合成酶、對傘花烴單加氧酶羥化酶和對傘花烴單加氧酶還原酶,用于生產(R)-(+)-紫蘇醇。從葡萄糖中得到(R)-(+)-紫蘇醇的單萜前體(R)-(+)-檸檬烯的濃度達到45 mg/L。從而實現了(R)-(+)-紫蘇醇的增強型生產。該菌株在5l的間歇式生物反應器中產生(R)-(+)-紫蘇醇,滴度為87 mg/L,葡萄糖產率為1.5 mg/g。這些數據強調了通過甲戊酸途徑從葡萄糖高效生產(R)-(+)-紫蘇醇。該方法為今后生產其他單萜類化合物提供了參考依據。[2]
眾所周知,在(S)-(?)-紫蘇醇生產過程中,使用大腸桿菌可使滴度提高100 mg/L。許多萜類化合物已經通過代謝工程高效價生產,包括單萜、倍半萜、二萜和四萜。以嗜熱硬脂芽孢桿菌(LHBS)的檸檬烯羥化酶為底物(R)-(+)-檸檬烯可產(R)-(+)-紫蘇醇0.51 mg/L。將LHBS連接到pET28a(+)中創建pSC00,同時創建pSC01中的cymAa和cymAb。檸檬烯對大多數微生物具有毒性,其濃度可以調節BL21 (DE3)的生長。因此,評價間歇式生產加料中檸檬烯的最佳濃度是很重要的。不同(R)-(+)-檸檬烯濃度評估(0.2 mM至3.0 mM)的生長試驗。隨著(R)-(+)-檸檬烯濃度的增加,細胞生長受到抑制。在(R)-(+)-檸檬烯濃度為1.0 mM時,SC01的OD600從2.5下降到2.0。當(R)-(+)-檸檬烯用量為2 mM時,SC01的最大產量為86.9 mg/L,紫蘇醇的轉化率為30%。另一株菌株SC00產生1.5 mg/L的低濃度,細胞生長受到抑制。在后續的研究中,以菌株SC01為研究基礎。產物經乙酸乙酯有機萃取后經GC-MS鑒定。對照試驗中大腸桿菌提取物缺乏cDNA克隆,不產生(R)-(+)-紫蘇醇,而攜帶惡臭假單胞菌cymAa和cymAb的大腸桿菌產生的(R)-(+)-紫蘇醇達到可檢測量。實驗結果表明以(R)-(+)-檸檬烯為底物成功構建了(R)-(+)-紫蘇醇的生物合成途徑。
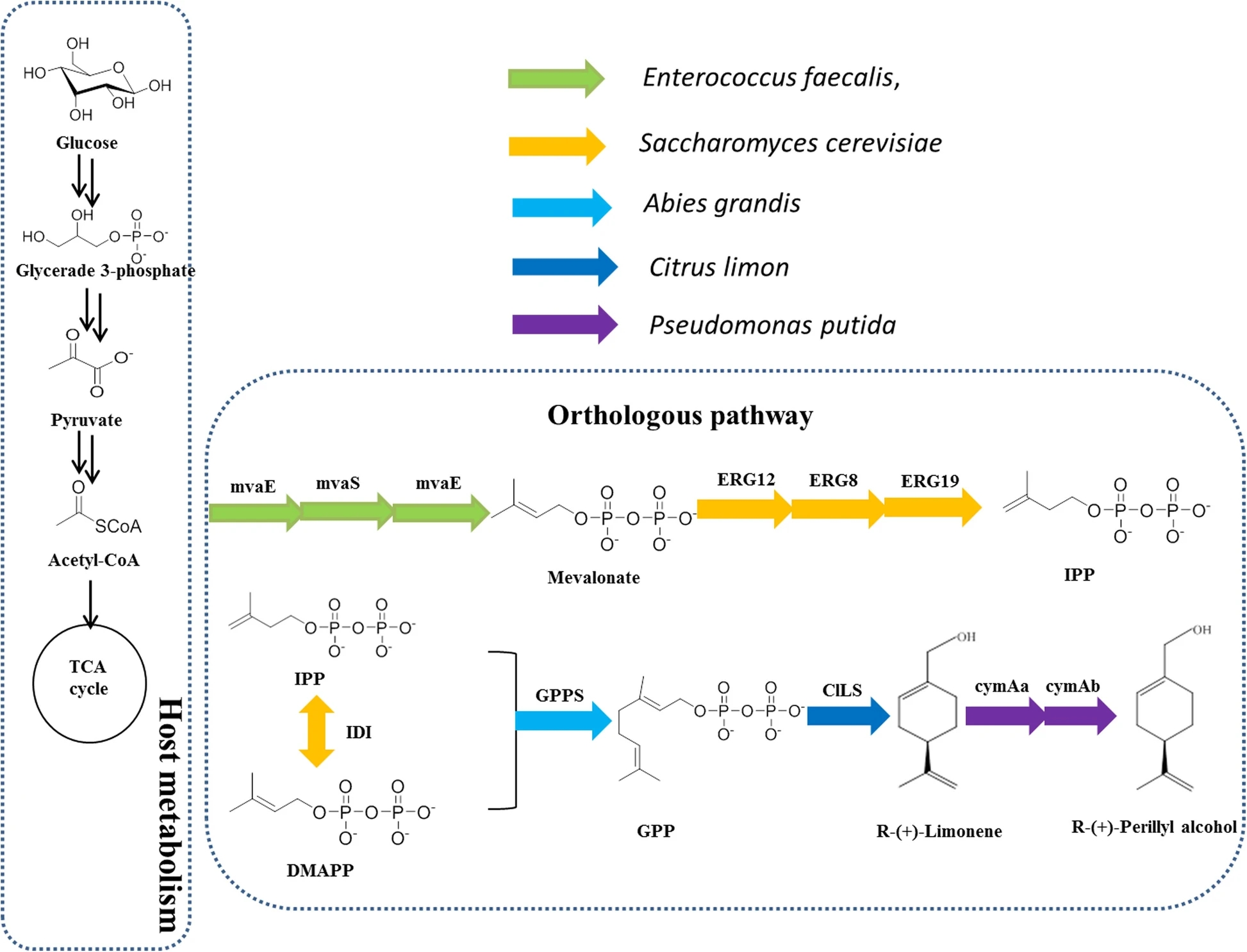
圖5 通過MVA途徑產生(R)-(+)-紫蘇醇
應用領域
1、紫蘇醇作為單體香料,是賦予枯茗香氣、龍涎香氣的化合物,可用于仿制柑橘、香草、水果型的食用香精,食品的賦香劑和醬油的防腐劑。
2、有機合成重要中間體,紫蘇醇是合成紫蘇醛、紫蘇葶等的關鍵中間體。
3、合成植物生產調節劑、農用殺蟲劑和昆蟲拒食劑。
4、紫蘇醇具有獨特的藥用效果,用于器官移植,可以降低同種異體移植物的排斥作用。
5、紫蘇醇作為一種治療及預防癌癥的單萜類藥物,具有廣譜、高效、低毒的抗癌作用特點,在腫瘤,如卵巢腫瘤、食道癌、乳腺癌等的治療方面有獨到的治療效果。
生物活性
Perillyl alcohol 是一種單萜醇,從薰衣草,薄荷,櫻桃等植物精油中分離出來。Perillyl alcohol 可在不影響正常細胞的情況下誘導腫瘤細胞凋亡 (apoptosis)。
1、紫蘇醇(單萜醇),檸檬烯
天然產物在傳統藥物中有著悠久的使用歷史,在過去的幾十年里,它們對不同疾病的作用一直是許多基礎和臨床研究的焦點。精油是一種含有植物芳香化合物的揮發性液體,被稱為中草藥中的有效成分。紫蘇醇(Perillyl alcohol, POH)通常可從飲食中獲得,目前正在探索其抗癌化學預防、腫瘤生長抑制和腫瘤消退的作用。柑桔果皮是果汁制造業的廢棄物,多年來一直被視為環境綠色生態政策的關鍵問題。克服這一問題最著名的方法之一是利用特定的細菌或酵母菌株來轉化這些單萜。檸檬烯(1-甲基-4-異丙基-環己烯)是一種單萜,因為其他單萜由兩個異戊二烯單元組成,占柑橘精油的90%以上,存在于許多水果和蔬菜中。盡管d -檸檬烯的抗癌活性早在20年前就已被發現,但它最近在轉化醫學上引起了更多的關注。在本章中,我們將概述POH和d -檸檬烯的抗癌作用。稍后,我們將討論這些化合物的藥代動力學,重點介紹這些蛋白質針對的信號通路,回顧在不同癌癥模型中對這些化合物進行的臨床試驗,最后討論了該領域未來的研究方向,可能更適用于未來的癌癥治療策略。
雖然目前還不清楚POH是如何激發其抗腫瘤作用的,但已經報道了一些潛在的重要機制。一種可能的機制是在不影響正常細胞的情況下,誘導和增強腫瘤細胞中轉化生長因子-β (TGF-β)信號轉導途徑的表達,進而引發細胞凋亡,誘導細胞停滯。然而,其他可能的機制包括,例如,抑制下游ras信號通路,調節AP-1(激活蛋白-1)的活性,G1早期阻滯,分化,抑制小Rho-GTPase蛋白的異丙烯化,生長因子的誘導,以及調節細胞周期檢查點蛋白的活性(圖6)。
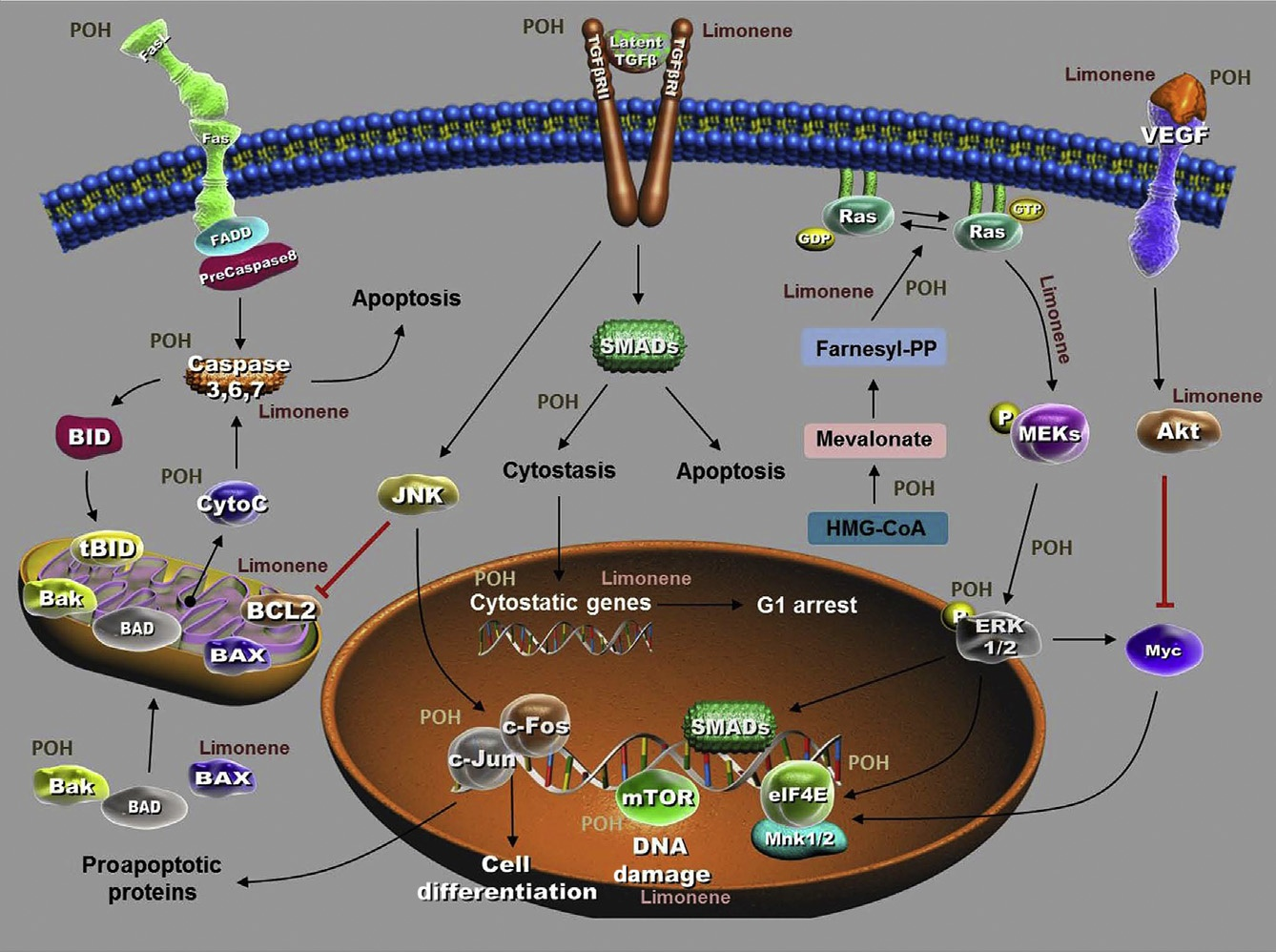
圖6 檸檬烯和紫蘇醇(POH)抗腫瘤作用示意圖。檸檬烯和POH在參與腫瘤進展和消退的一些關鍵途徑中具有多種抑制和刺激作用。這兩種天然產物都在細胞死亡的調控中發揮重要作用。檸檬烯通過上調BAX、釋放細胞色素c、caspase-3、-9、TGF-β和下調抗凋亡Bcl-2發揮作用。POH還上調Bak、caspase-3、FasL、TGF-β、c-fos和c-Jun,并阻斷ERK1/2磷酸化和Mek-Erk通路。檸檬烯和POH都可以通過下調癌細胞中VEGF的基礎生成來抑制腫瘤進展。它們還能抑制甲戊酸途徑以及小G蛋白的異戊烯化,導致腫瘤消退。
POH可通過抑制甲戊酸途徑發揮膽固醇生物合成的調節作用。根據對膽固醇生物合成的影響,有報道稱,在一項研究中觀察到,服用POH的老鼠體重下降了近10%,這是由于體脂減少。先前的研究也表明,POH能夠通過阻斷3-羥基-3-甲基戊二酰輔酶A向甲戊酸的轉化,進而抑制小Rho-GTPase蛋白和3-羥基-3-甲基戊二酰輔酶A還原酶的合成來影響甲戊酸途徑,導致異戊烯化Ras和Ras相關蛋白的活性降低。因此,它被認為是一種戊烯基轉移酶抑制劑。法尼酰基化是Ras基因突變體活性所必需的,而法尼酰基轉移酶(FTase)抑制劑可阻斷Ras基因的致癌活性。然而,一個有趣的說法是,這種單萜可以以一種不依賴Ras的方式對白血病細胞產生抗癌作用。這一發現支持了一種觀點,即在Ras依賴和Ras獨立途徑中,存在其他可能的機制導致其對不同類型的惡性細胞的癌癥化學預防作用。在不影響正常對照的情況下,Bcl-2同源拮抗劑/殺手(BAK)在腫瘤中誘導凋亡(一種促凋亡蛋白),證實POH對胰腺癌的增殖抑制作用。POH作用于肝臟腫瘤的機制是通過刺激TGF-β和M6P/IGF II(甘露糖-6-磷酸/胰島素樣生長因子-II)受體,增加腫瘤細胞的損失率。抑制絲裂原/細胞外信號調節激酶(Mek) -細胞外信號調節激酶(Erk)通路被認為是POH的另一作用機制。與這一觀點一致的是,另一項研究報道POH通過阻斷K562細胞中的ERK1/2磷酸化和小GTPase信號通路,在誘導細胞凋亡中發揮關鍵作用。這些結果表明,POH可能有幾個靶點,當被該途徑激活時,可能是關鍵的癌癥治療。POH還可以下調癌細胞中血管內皮生長因子(VEGF)的基礎生成,上調內皮細胞中血管生成素-2的釋放,導致腫瘤消退。POH的靶向途徑見圖6。
一項研究表明,在膠質瘤細胞中,POH通過增加Fas配體的表達來發揮其作用,從而增強化療的傳遞和療效。POH的化學預防作用通過抑制UVB誘導的AP-1活化在體內外皮膚腫瘤的促進作用得到證實。這一發現與在人乳腺腫瘤細胞株T47D-C4-2W中的研究結果不一致,該研究表明poh通過c-Jun n端激酶/應力激活蛋白激酶途徑誘導c-fos和c-Jun(兩個相互結合形成AP-1的癌蛋白)的轉錄活性,并隨后激活AP-1。另一項臨床前研究證實POH在乳腺癌中通過改變c-Jun和c-fos的功能,并誘導BAX和bad等促凋亡基因表達,參與TGF-β下游基因表達的激活和AP-1的誘導。c-Jun和c-fos在細胞凋亡前和凋亡過程中均被激活,POH的刺激可能是導致細胞死亡的信號級聯的早期關鍵事件。POH對雄激素受體(AR)基因表達的抑制和對c-Jun表達的刺激可減弱AR介導的雄激素反應性前列腺細胞的作用。POH也被證明參與抑制人類乳腺癌細胞株的細胞生長、細胞周期進展和cyclin D1基因表達。其他體外研究報道了POH對胰腺癌和肺癌細胞[52]生長的抑制作用。研究證實,細胞周期蛋白D1和E的降低、p21 (Cip1/Waf1)的增強和PCNA表達的降低有助于在培養的人乳腺癌細胞中實現細胞周期阻滯。這是POH在裸鼠系統中抗人乳腺癌細胞增殖和轉移的作用機制。Balassiano等研究了POH對膠質細胞C6細胞系和雞胚絨毛膜模型的影響,發現POH在體外和體內均發揮了抗轉移分子的作用。體外實驗表明,POH通過破壞細胞骨架機制來抑制乳腺細胞的遷移,而不影響細胞黏附。體外研究表明,POH在神經母細胞瘤衍生的神經- 2a細胞中起誘導分化作用。將這些細胞與POH孵育后,發現它抑制了DNA合成。對POH誘導腫瘤生長衰退部位的組織學觀察表明,POH與腫瘤細胞的再分化有關。最近,人們提出了另一種POH抑制前列腺癌進展的機制,該機制可以通過獨特的協同降低hTERT(人端粒酶逆轉錄酶)蛋白翻譯和破壞hTERT - mtor(雷帕霉素的機制靶點)-RAPTOR蛋白復合物來調節端粒酶活性。結果證實了致瘤性休克的假說。他們發現POH對端粒酶和TERT蛋白的調節與eIF4E(真核翻譯起始因子4E)水平高相關,而對eIF4E水平低的正常pMV7細胞則無影響。POH的作用機理概述如圖6所示。
2、單萜紫蘇醇:抗癌劑和克服生物屏障的介質
紫蘇醇(POH)是一種與檸檬烯有關的天然單萜,存在于各種植物的精油中。它有多種用途,可以在家庭用品中找到,包括食品、化妝品和清潔用品。在過去的三十年里,人們也對其潛在的抗癌活性進行了研究。盡管鼻腔內POH制劑在惡性膠質瘤患者中產生了令人鼓舞的結果,但在癌癥患者中使用口服POH制劑的臨床試驗未能實現預期的治療效果。基于它的兩性特性,POH顯示了克服生物屏障的能力,主要是血腦屏障(BBB),但也有細胞質膜和皮膚,這似乎是POH在藥物開發和傳遞方面的重要貢獻。在這篇綜述中,我們介紹了POH的物理化學性質,這是它能夠克服不同類型生物屏障所帶來的障礙的基礎,從而塑造了它在癌癥治療和藥物開發中的多方面前景。我們總結和評價了大量的臨床前和臨床研究,這些研究探討了POH在鼻內給藥和鼻到腦的藥物運輸、其動脈內給藥用于血腦屏障打開以及其在雜化分子中的滲透增強功能,POH與其他治療藥物結合或偶聯,產生具有新的作用機制和應用的新的化學實體。[4]
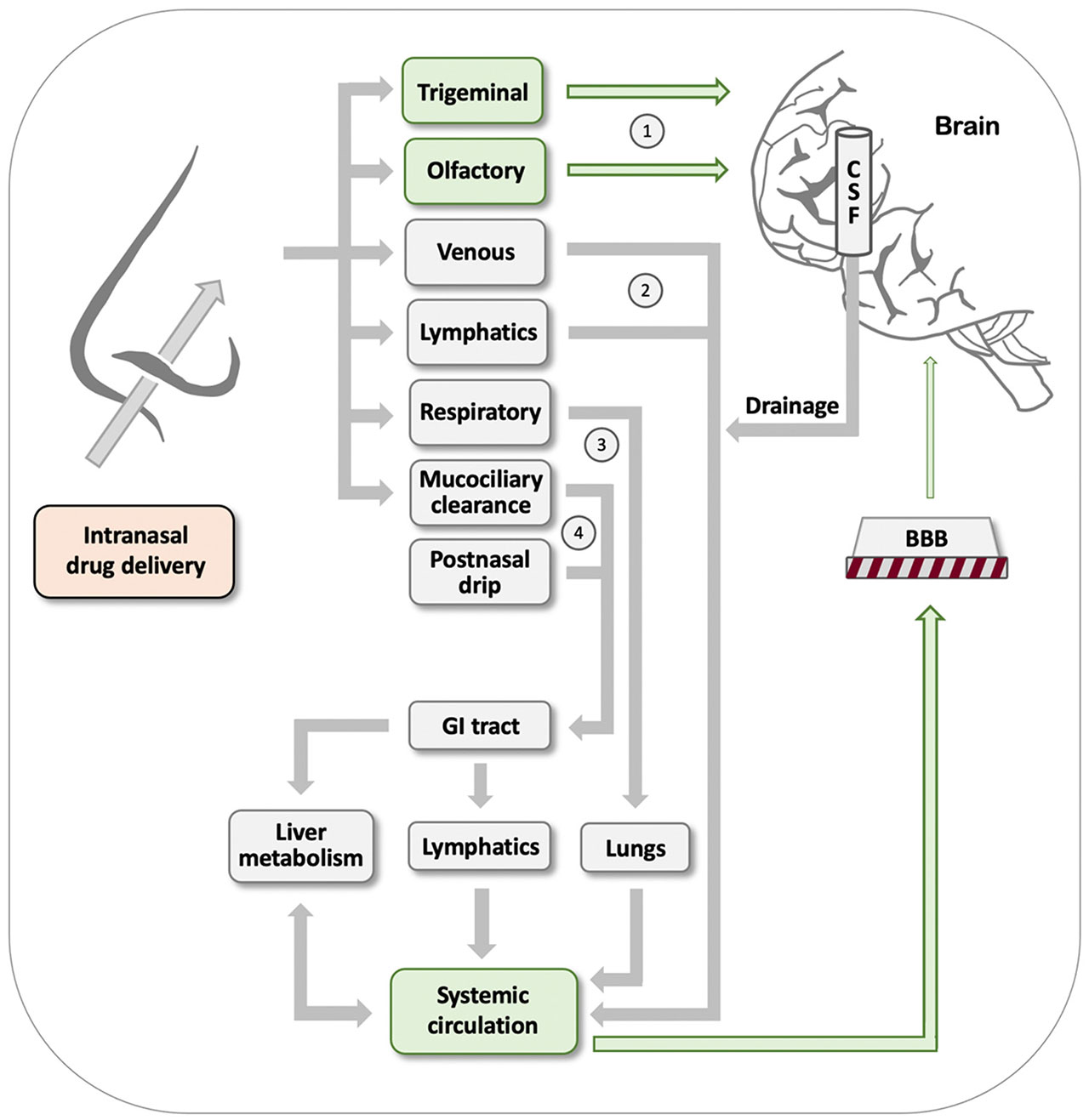
圖7 可用于鼻內給藥的途徑。經鼻給藥后,藥物可能通過幾種截然不同的途徑到達大腦:通過三叉神經和嗅覺神經(標記為1)直接從鼻子到大腦的運輸,或通過標記為2-4的機制首次進入血液的間接運輸。然而,在后一種途徑中,藥物會遇到血腦屏障,這阻止了絕大多數藥物制劑有效地進入大腦。詳情請參閱文本。[4]
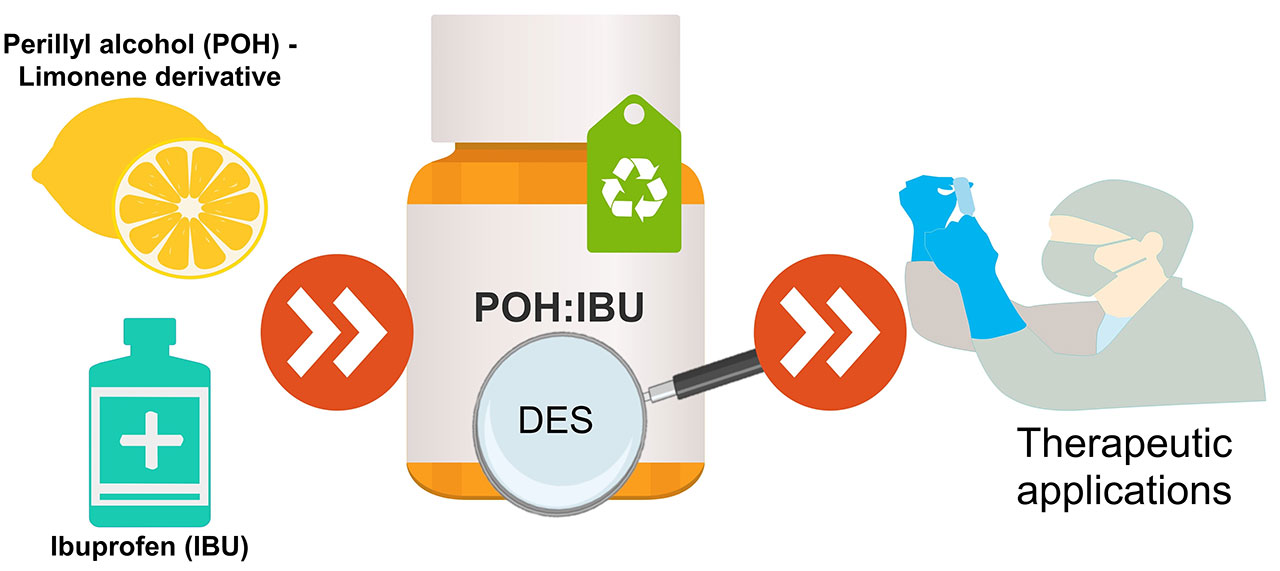
3、紫蘇醇和布洛芬基底物的優化設計
治療性深共晶體系(THEDES)由于能夠提高活性藥物成分(APIs)的生物利用度,在制藥領域得到了廣泛的應用。然而,它們的生物學性能還沒有被仔細研究過。以紫蘇醇(POH)和布洛芬(IBU)為原料,采用不同的摩爾比制備了二乙基醚。我們的綜合策略包括表征它們的熱和結構行為,以確定成功形成深共晶體系的摩爾比。制備的不同體系的體外溶解度表明,與其他報道的例子不同,萜烯的存在并不影響抗炎劑在生理模擬介質中的溶解度。該系統的生物性能是研究他們的抗菌活性對廣泛的微生物菌群。除銅綠假單胞菌外,THEDES對所有供試菌株均有抗菌活性。驗證了POH和IBU作為共晶體系的結合具有協同效應。此外,在體外細胞模型中,也評估了這些共晶系統對結直腸癌(CRC)的細胞毒性。結果表明,細胞活力以劑量依賴性的方式變化,有選擇性的THEDES作用于CRC細胞。隨著可調節的生物活性在一個比例依賴的方式,THEDES增強了抗菌和抗癌的特性,代表了一個可能的替代傳統療法。因此,本研究為基于POH和IBU的THEDES作為新型活性藥物系統的強大候選藥物的應用提供了可預見的方向。[5]
4、不同載體中紫蘇醇的釋放
背景:皮膚癌是人類最常見的惡性腫瘤,在過去的幾十年里,皮膚癌的病例數量急劇增加。因此,開展新的和更安全的抗癌天然藥物(如紫蘇醇)和現代藥物傳遞系統(如納米制劑)的研究,以提高其生物利用度是非常重要的。
目的:研究不同劑型紫蘇醇的體外緩釋作用,并比較其緩釋效果。利用選定的數學模型確定了釋放動力學。
方法:采用水凝膠、O/W納米乳液、O/W大乳液和納米脂質載體作為紫蘇醇的載體。使用Spectra/Por標準再生纖維素膜,在溫度T=32℃下進行活性成分的釋放研究。用高效液相色譜法分析了受體溶液中活性藥物的濃度。利用選定的數學模型確定了釋放動力學。
結果:紫蘇醇的釋放量分別為水凝膠(35.72±0.21%)、NLC(35.54±1.48%)和納米乳(34.87±4.49%)。在水凝膠和大乳狀液中,其釋放遵循fick擴散規律,而在納米制劑中則表現出一種反常的機制。然而,獲得的納米制劑以及常規水凝膠可被認為是紫蘇醇局部給藥的潛在載體。[6]
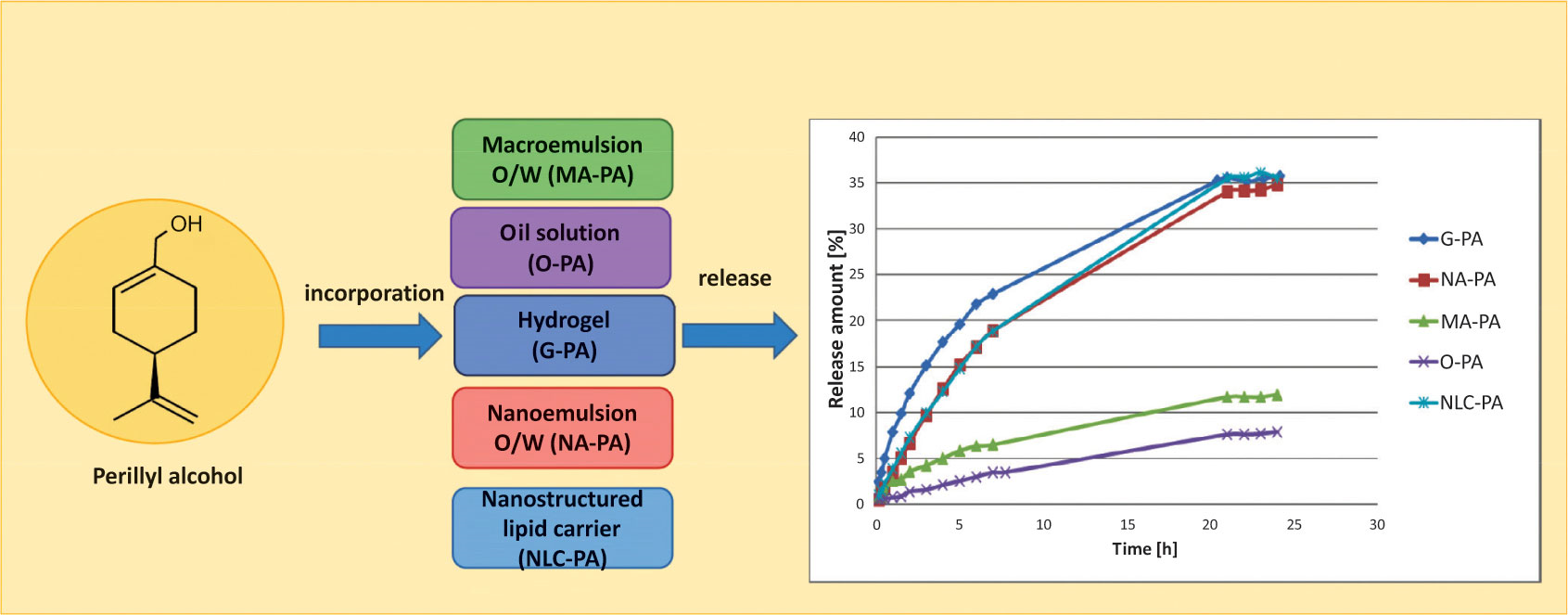
圖8 不同載體中紫蘇醇的釋放動力學曲線[6]
參考文獻
[1] Cornelissen, Sjef & Liu, Shanshan & Deshmukh, Amit & Schmid, Andreas & Bühler, Bruno. (2011). Cell physiology rather than enzyme kinetics can determine the efficiency of cytochrome P450-catalyzed C-H-oxyfunctionalization. Journal of industrial microbiology & biotechnology. 38. 1359-70. 10.1007/s10295-010-0919-y.
[2] Sun, C., Dong, X., Zhang, R. et al. Effectiveness of recombinant Escherichia coli on the production of (R)-(+)-perillyl alcohol. BMC Biotechnol 21, 3 (2021). https://doi.org/10.1186/s12896-020-00662-7
[3] Shojaei, Shahla & Kiumarsi, Amir & Rezaei Moghadam, Adel & Alizadeh, Javad & Marzban, Hassan & Ghavami, Saeid. (2014). Perillyl Alcohol (Monoterpene Alcohol), Limonene. 10.1016/B978-0-12-802215-3.00002-1.
[4] Chen TC, da Fonseca CO, Levin D, Sch?nthal AH. The Monoterpenoid Perillyl Alcohol: Anticancer Agent and Medium to Overcome Biological Barriers. Pharmaceutics. 2021; 13(12):2167. https://doi.org/10.3390/pharmaceutics13122167
[5] Silva E, Oliveira F, Silva JM, Matias A, Reis RL, Duarte ARC. Optimal Design of THEDES Based on Perillyl Alcohol and Ibuprofen. Pharmaceutics. 2020; 12(11):1121. doi. 10.3390 / pharmaceutics 12111121
[6]Miastkowska Malgorzata *, Konieczna Monika , Lason Elwira , Tabaszewska Malgorzata , Sikora Elzbieta and Ogonowski Jan, The Release of Perillyl Alcohol from the Different Kind of Vehicles, Current Pharmaceutical Biotechnology 2018; 19(7) .doi.org/10.2174/1389201019666180730165330